Ce que la chaleur peut nous apprendre sur la chimie des piles
Utilisation de l'effet Peltier pour étudier les cellules lithium-ion
Annonces
Les batteries sont généralement étudiées en fonction de leurs propriétés électriques, telles que la tension et le courant, mais de nouvelles recherches suggèrent que l'observation de la façon dont la chaleur circule en conjonction avec l'électricité peut donner des indications importantes sur la chimie des batteries.
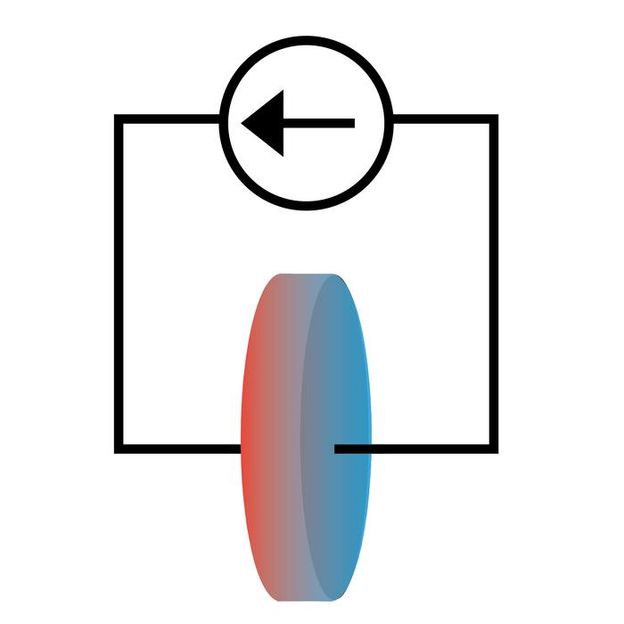
Les chercheurs ont étudié comment le courant électrique créait des flux de chaleur dans une cellule de batterie lithium-ion. La chaleur circule à l'opposé du courant électrique, ce qui se traduit par une température plus élevée du côté où le courant pénètre dans la cellule.
The Grainger College of Engineering at University of Illinois Urbana-Champaign
Une équipe de chercheurs de l'université de l'Illinois Urbana-Champaign a démontré comment étudier les propriétés chimiques des cellules de batteries lithium-ion en exploitant l'effet Peltier, dans lequel le courant électrique provoque un dégagement de chaleur dans un système. Publiée dans la revue Physical Chemistry Chemical Physics, cette technique leur a permis de mesurer expérimentalement l'entropie de l'électrolyte lithium-ion, une caractéristique thermodynamique qui pourrait directement influencer la conception des batteries lithium-ion.
"Notre travail consiste à comprendre la thermodynamique fondamentale des ions lithium dissous, une information qui, nous l'espérons, guidera le développement de meilleurs électrolytes pour les batteries", a déclaré David Cahill, professeur de science et d'ingénierie des matériaux à l'Université de l'Iowa et responsable du projet. "La mesure du transport couplé de la charge électrique et de la chaleur dans l'effet Peltier nous permet de déduire l'entropie, une quantité qui est étroitement liée à la structure chimique des ions dissous et à la façon dont ils interagissent avec d'autres parties de la batterie.
L'effet Peltier est bien étudié dans les systèmes à l'état solide où il est utilisé pour le refroidissement et la réfrigération. Cependant, il reste largement inexploré dans les systèmes ioniques tels que l'électrolyte de lithium. La raison en est que les différences de température créées par le chauffage et le refroidissement Peltier sont faibles par rapport à d'autres effets.
Pour surmonter cet obstacle, les chercheurs ont utilisé un système de mesure capable de résoudre un centième de millième de degré Celsius. Ils ont ainsi pu mesurer la chaleur entre les deux extrémités de la cellule et l'utiliser pour calculer l'entropie de l'électrolyte lithium-ion dans la cellule.
"Nous mesurons une propriété macroscopique, mais cela révèle des informations importantes sur le comportement microscopique des ions", a déclaré Rosy Huang, étudiante diplômée dans le groupe de recherche de Cahill et co-auteur principal de l'étude. "Les mesures de l'effet Peltier et de l'entropie de la solution sont étroitement liées à la structure de solvatation. Auparavant, les chercheurs spécialisés dans les batteries s'appuyaient sur des mesures d'énergie, mais l'entropie apporterait un complément d'information important qui donnerait une image plus complète du système".
Les chercheurs ont étudié l'évolution du flux de chaleur Peltier en fonction de la concentration en ions lithium, du type de solvant, du matériau de l'électrode et de la température. Dans tous les cas, ils ont observé que le flux de chaleur était opposé au courant ionique dans la solution, ce qui implique que l'entropie de la dissolution des ions lithium est inférieure à l'entropie du lithium solide.
La possibilité de mesurer l'entropie des solutions électrolytiques lithium-ion peut donner des indications importantes sur la mobilité des ions, qui régit le cycle de recharge de la batterie, et sur la manière dont la solution interagit avec les électrodes, un facteur important pour la durée de vie de la batterie.
"Un aspect sous-estimé de la conception des batteries est que l'électrolyte liquide n'est pas chimiquement stable lorsqu'il est en contact avec les électrodes", a déclaré M. Cahill. "Il se décompose toujours et forme ce que l'on appelle une interphase solide-électrolyte. Pour qu'une batterie soit stable sur de longs cycles, il faut comprendre la thermodynamique de cette interphase, ce que notre méthode permet de faire".
Note: Cet article a été traduit à l'aide d'un système informatique sans intervention humaine. LUMITOS propose ces traductions automatiques pour présenter un plus large éventail d'actualités. Comme cet article a été traduit avec traduction automatique, il est possible qu'il contienne des erreurs de vocabulaire, de syntaxe ou de grammaire. L'article original dans Anglais peut être trouvé ici.