Cientistas desvendam o mecanismo subjacente à produção de amoníaco mais ecológico
Anúncios
Investigadores da Universidade Metropolitana de Tóquio revelaram como um catalisador de uma reação química promissora para a indústria ajuda a produzir amoníaco, um dos principais ingredientes dos fertilizantes. O óxido de cobre é um catalisador fundamental na reação eletroquímica de redução de nitratos, uma alternativa mais ecológica ao atual processo Haber-Bosch. Descobriram que as partículas de cobre são criadas a meio da reação, ajudando a converter os iões de nitrito em amoníaco. Este conhecimento dos mecanismos subjacentes promete um grande avanço no desenvolvimento de uma nova química industrial.
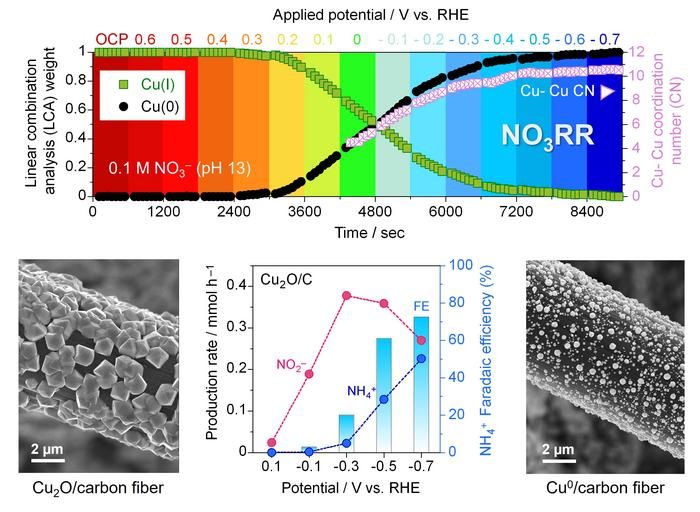
(topo) Proporção de cobre (I) em óxido de cobre e cobre (0) em partículas de cobre metálico sob diferentes tensões aplicadas. Uma voltagem mais negativa correlaciona-se com o aparecimento de mais ligações Cu-Cu. (em baixo à esquerda) Imagem de microscopia eletrónica de varrimento (SEM) de partículas de óxido de cobre montadas em fibra de carbono. (em baixo, a meio) Taxa de produção de iões de nitrito e amónio em diferentes tensões e eficiência da produção de amónio. (em baixo, à direita) Imagem SEM de partículas de cobre metálico em fibra de carbono.
Tokyo Metropolitan University
Como ingrediente dos fertilizantes, o amoníaco é um químico importante na agricultura industrial. A forma mais amplamente adoptada para produzir amoníaco é o processo Haber-Bosch, em que o azoto e o hidrogénio reagem a alta temperatura e pressão. Isto torna o processo intensivo em energia; diz-se que é responsável por cerca de 1,4% das emissões globais de dióxido de carbono. Sendo um produto químico que está na base de grande parte da produção de alimentos, a procura de formas mais ecológicas de produzir amoníaco está em curso.
Uma equipa liderada pelo Professor Fumiaki Amano da Universidade Metropolitana de Tóquio tem vindo a estudar a reação eletroquímica de redução de nitratos, uma alternativa promissora que pode produzir amoníaco a partir de nitratos à temperatura e pressão ambiente. Os processos electroquímicos funcionam através da colocação de eléctrodos numa mistura química e da aplicação de uma tensão para provocar reacções. Apesar dos numerosos estudos que identificam reacções específicas que ocorrem nos eléctrodos à medida que o amoníaco é produzido, o mecanismo exato tem-se revelado difícil de compreender.
Utilizando técnicas de ponta, a equipa obteve uma visão sem precedentes do modo como o amoníaco é produzido na presença de um catalisador de óxido de cobre, um dos electrocatalisadores mais eficazes para este tipo de reação. Utilizaram a absorção operando de raios X, um método que combina a perceção dos estados electrónicos com o conhecimento das ligações e da estrutura locais. Montando pequenas partículas de óxido de cobre em fibras de carbono, conseguiram extrair a forma como as coisas mudam à medida que a tensão se torna mais negativa durante a reação. Sob uma tensão positiva, foi demonstrado que os iões de nitrato "passivam" o catalisador, absorvendo-o e impedindo a conversão do óxido de cobre em cobre metálico, produzindo, em vez disso, iões de nitrito. À medida que a tensão se torna mais negativa, observa-se um aumento abrupto da produção de amoníaco. Isto acontece ao mesmo tempo que o aparecimento de partículas de cobre metálico, evidenciado por um aumento dramático do número de ligações cobre-cobre. Descobriram que o cobre metálico está a ajudar a adicionar hidrogénio aos iões de nitrito para produzir amoníaco.
As medições da equipa mostraram como a passivação da superfície afecta a eficiência do catalisador de óxido de cobre e como a produção de cobre metálico é crucial para a produção eficiente de amoníaco. O seu trabalho destaca uma vasta classe de estratégias para otimizar a produção de amoníaco verde e conceber novos catalisadores electroquímicos.
Este trabalho foi apoiado pela Universidade Metropolitana de Tóquio e pelo Tokyo Global Partner Scholarship Program e baseou-se nos resultados obtidos no projeto JPNP14004 encomendado pela New Energy and Industrial Technology Development Organization (NEDO).
Observação: Este artigo foi traduzido usando um sistema de computador sem intervenção humana. A LUMITOS oferece essas traduções automáticas para apresentar uma gama mais ampla de notícias atuais. Como este artigo foi traduzido com tradução automática, é possível que contenha erros de vocabulário, sintaxe ou gramática. O artigo original em Inglês pode ser encontrado aqui.





































