La chimie rencontre la biologie : contrôler les membranes cellulaires artificielles par la catalyse
Des chercheurs développent une plate-forme artificielle à base de métalloenzymes qui permet un contrôle programmable du comportement des membranes artificielles
Annonces
Grâce à la chimie catalytique, des chercheurs de l'Institut des sciences de Tokyo sont parvenus à contrôler la dynamique des membranes artificielles, ce qui leur permet d'avoir un comportement semblable à celui de la vie. En employant un métalloenzyme artificiel qui effectue une réaction de métathèse par fermeture d'anneau, l'équipe a induit la disparition de domaines séparés en phase ainsi que la division de la membrane dans les membranes artificielles, imitant ainsi le comportement dynamique des membranes biologiques naturelles. Cette recherche transformatrice marque une étape importante dans les technologies cellulaires synthétiques, ouvrant la voie à des percées thérapeutiques innovantes.
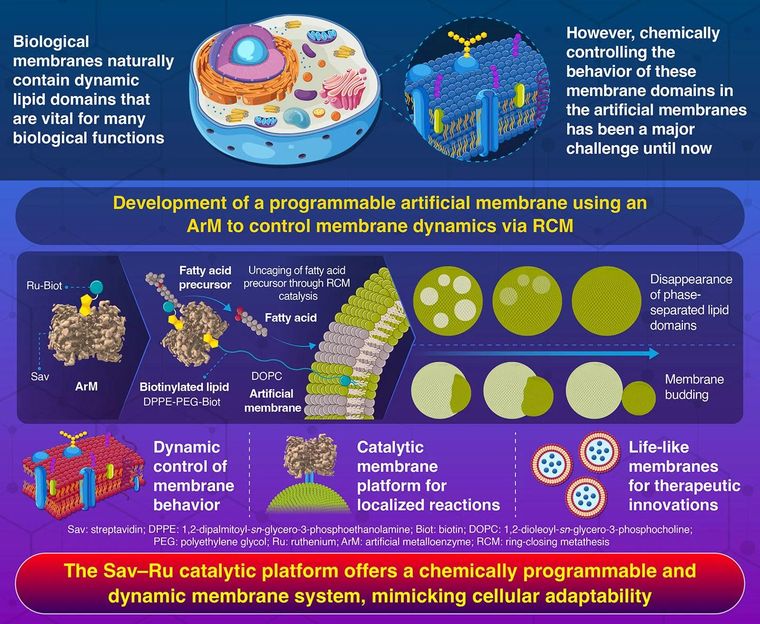
Membranes cellulaires artificielles programmables contrôlées par une réaction chimique catalytique
Les membranes biologiques sont des structures fondamentales qui forment les limites de toutes les cellules vivantes, contrôlant la façon dont les cellules communiquent, se développent et réagissent à leur environnement. Ces membranes sont composées de différentes molécules, telles que des lipides et des protéines, qui s'organisent en une couche membranaire. Dans certaines circonstances, les molécules se regroupent en régions fonctionnelles locales qui régulent des processus biologiques spécifiques. Ces régions regroupées sont connues sous le nom de domaines à phase séparée et sont distinctes de la membrane environnante.
Comprendre et reproduire les comportements dynamiques de ces régions fascine depuis longtemps les scientifiques qui cherchent à construire des cellules artificielles se comportant comme des cellules naturelles. Cependant, comme la plupart des modèles de membranes artificielles restent statiques, la reproduction de ces propriétés adaptatives des membranes biologiques est restée un défi majeur jusqu'à présent. Pour relever ce défi, des chercheurs de l'Institut des sciences de Tokyo (Science Tokyo), au Japon, et de l'Université de Bâle, en Suisse, ont mis au point une nouvelle stratégie chimique pour contrôler le comportement des membranes cellulaires artificielles.
L'étude a été menée par le professeur Kazushi Kinbara et le doctorant Rei Hamaguchi de la School of Life Science and Technology, Science Tokyo, Japon, en collaboration avec le professeur Thomas R. Ward de l'université de Bâle, Suisse. Les résultats ont été mis en ligne le 15 octobre 2025 et publiés dans le volume 147, numéro 43 du Journal of the American Chemical Society le 29 octobre 2025.
Pour donner vie aux membranes, les chercheurs ont d'abord construit de minuscules structures artificielles semblables à des cellules, appelées vésicules lipidiques. Ils ont ensuite construit un catalyseur hybride appelé métalloenzyme artificielle (ArM) - une combinaison d'une protéine biologique, la streptavidine (Sav), et d'un catalyseur métallique synthétique (complexe métallique de ruthénium) portant une fraction de biotine (vitamine B7). Cette enzyme agit comme un catalyseur sur la membrane, réalisant une réaction chimique critique connue sous le nom de métathèse par fermeture de cycle (RCM).
Pour fixer le catalyseur ArM à la surface de la membrane lipidique, l'équipe a également incorporé un type spécial de lipide marqué à la biotine dans la membrane, qui a servi d'ancre au catalyseur.
"Lorsqu'il est déclenché par des précurseurs d'acides gras, le système ArM libère des acides gras libres par l'intermédiaire de la RCM", explique Kinbara. "Ces acides gras se glissent dans la membrane, modifiant subtilement sa structure et entraînant un comportement dynamique de la membrane.
Les simulations moléculaires ont révélé les mécanismes clés qui sous-tendent ces transformations. Les précurseurs d'acides gras inactifs et encagés ont d'abord été activés par le catalyseur ArM par le biais de la réaction RCM. Cette réaction désencage les précurseurs d'acides gras encagés, libérant des acides gras libres près de la membrane. Les acides gras libérés s'insèrent naturellement dans la surface de la membrane, modifiant sa rigidité et sa courbure, ce qui entraîne des transformations visibles telles que la disparition des domaines séparés par des phases et la division de la membrane.
"C'est un peu comme si l'on donnait à une membrane synthétique la capacité de respirer et de réagir", explique M. Kinbara. "En contrôlant une réaction chimique à la surface de la membrane, nous pouvons la faire se réorganiser, comme le fait une cellule vivante.
Cette découverte marque la première tentative de programmer chimiquement le comportement physique de membranes artificielles, ouvrant la voie à la création de matériaux semblables à la vie, capables de percevoir leur environnement et d'y réagir. Non seulement elle fait progresser la biologie synthétique, mais elle introduit également un schéma directeur pour la création de membranes artificielles programmables qui pourraient inspirer de futures innovations thérapeutiques, comblant ainsi le fossé entre la chimie et la vie.
Note: Cet article a été traduit à l'aide d'un système informatique sans intervention humaine. LUMITOS propose ces traductions automatiques pour présenter un plus large éventail d'actualités. Comme cet article a été traduit avec traduction automatique, il est possible qu'il contienne des erreurs de vocabulaire, de syntaxe ou de grammaire. L'article original dans Anglais peut être trouvé ici.