Le CO2, une matière première durable
L'université technique de Berlin présente un électrolyseur tandem pour une économie circulaire utilisant le dioxyde de carbone
Annonces
Des scientifiques* de l'Université technique de Berlin ont présenté une combinaison de deux cellules d'électrolyse qui peuvent transformer directement le dioxyde de carbone et l'eau en produits chimiques de base pour l'industrie chimique à l'aide d'électricité. La première électrolyse produit d'abord du monoxyde de carbone à partir du dioxyde de carbone, qui forme ensuite des hydrocarbures avec l'eau dans la deuxième cellule d'électrolyse. Contrairement aux catalyseurs métalliques onéreux habituellement utilisés, on utilise ici une électrode en carbone dopée avec quelques atomes de nickel et de l'azote, qui ne nécessite qu'une proportion de métal inférieure à un pour cent. En outre, les chercheurs* ont développé un système de diagnostic qui surveille l'état de l'électrolyseur tandem pendant son fonctionnement, contribuant ainsi à une plus longue durée de vie et à une meilleure compréhension des processus chimiques dans les cellules.
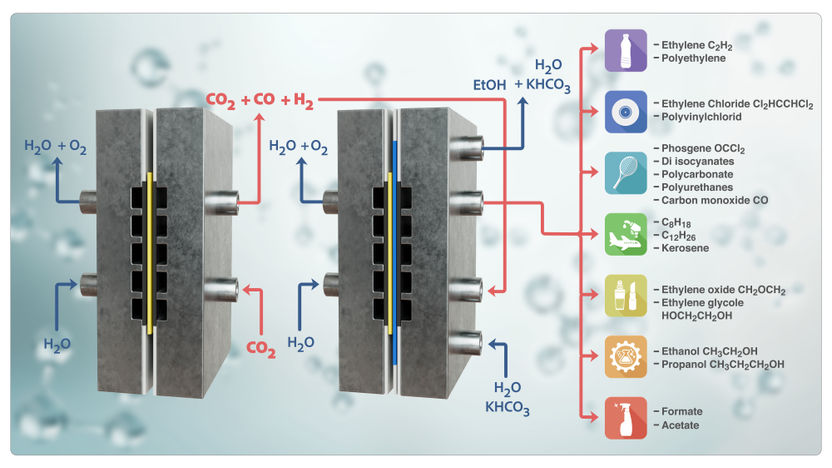
Schéma de réaction de l'électrolyseur tandem
© TU Berlin
Extraire le dioxyde de carbone de l'air ou directement des gaz d'échappement et le transformer en produits chimiques précieux à l'aide d'électricité issue de sources d'énergie renouvelables - cela semble être la voie idéale pour lutter contre la crise climatique. La clé est l'électrolyse. Elle peut réduire le dioxyde de carbone (CO2) en monoxyde de carbone (CO) pratiquement pur à l'aide d'eau (H2O) et d'électricité, tout en produisant de l'oxygène (O2). Le monoxyde de carbone et l'eau supplémentaire peuvent alors réagir dans une deuxième étape pour former des hydrocarbures utiles, comme l'éthylène, qui sont constitués de chaînes plus longues d'atomes de carbone et d'hydrogène.
Meilleur rendement et efficacité énergétique avec les cellules d'électrolyse en tandem
"Dans le cas de l'électrolyse de l'eau etdu CO2 en CO et d'un peu d'hydrogène comme sous-produit, la part de CO dans la quantité totale de substances transformées est bien plus élevée que dans les processus thermiques alternatifs qui utilisent de l'hydrogène vert etdu CO2 pour produire du CO et de l'eau à des températures d'environ 800 degrés", explique le professeur Peter Strasser, directeur du département "Electrochemical Catalysis, Energy and Materials Sciences" à l'Université technique de Berlin, pour décrire les avantages de la méthode. Pour la deuxième étape, la production de produits chimiques de base pour l'industrie chimique à partir de CO et d'eau, il existe plusieurs procédés concurrents, a-t-il ajouté. "Si cette étape est également réalisée par voie électrochimique, cela se fait jusqu'à présent souvent dans la même cellule d'électrolyse que celle dans laquelle le CO est produit. Pour que tous les processus nécessaires se déroulent ici l'un après l'autre, il faut bien sûr faire des compromis au niveau du catalyseur et des conditions chimiques, ce qui conduit à des résultats sous-optimaux. Nous utilisons donc deux cellules en tandem, l'une fournissant du CO qui est ensuite directement transformé en précieux hydrocarbures dans la deuxième cellule". Selon la formulation du catalyseur, la deuxième étape produit notamment des hydrocarbures très réactifs comme l'éthylène, le propylène et un peu d'acétylène, mais aussi des composés liquides comme le méthanol, l'éthanol et le propanol ou l'acétate.
Moins de besoin en métal grâce à la nouvelle électrode en carbone
Pierre Strasser et son équipe empruntent également de nouvelles voies pour l'électrode qui transforme leCO2 en CO. Normalement, le matériau utilisé ici est l'argent, qui sert de catalyseur pour les réactions chimiques. "Non seulement il est rare et cher, mais il peut aussi se corroder et former des films à sa surface, ce qui nuit à sa fonction de catalyseur", explique le doctorant Sven Brückner, premier auteur de la publication. "C'est pourquoi nous utilisons une électrode en carbone dans laquelle des atomes des éléments nickel et azote ont été incorporés à certains endroits pour servir de catalyseur". Comme le carbone utilisé est poreux et présente donc une grande surface, et que les atomes intégrés à l'aide d'un procédé spécial ne se trouvent eux-mêmes qu'en surface, la part de nickel nécessaire peut être maintenue extrêmement faible - elle représente moins d'un pour cent du poids total.
"Comme de telles électrodes n'existent que depuis quelques années et qu'elles doivent toujours être optimisées en fonction de leur utilisation, leur durée de vie ainsi que la puissance maximale du catalyseur pouvant être atteinte font encore l'objet de recherches", rapporte Brückner. Mais comme l'électrode est fabriquée à des températures plus élevées que la température de fonctionnement et que d'autres conditions chimiques sont plus douces pendant le fonctionnement que lors de la fabrication, il est optimiste quant à l'obtention prochaine de résultats dans ce domaine. L'équipe espère prolonger considérablement la stabilité actuelle de quelques centaines d'heures.
Outil de diagnostic pour une recherche optimisée et une durée de vie plus longue
D'autres paramètres de fonctionnement de la cellule tandem doivent également être optimisés. "Le rapport entre le monoxyde de carbone et le sous-produit hydrogène dans la première cellule dépend du pH de l'électrolyte", explique Sven Brückner. Comme le procédé doit fournir la plus grande quantité possible de CO comme élément constitutif des hydrocarbures, l'électrolyse du CO2 est réalisée dans des conditions basiques qui favorisent la formation de monoxyde de carbone. "Mais cela a pour conséquence que les ions OH réagissent avec leCO2 dans l'électrolyte basique pour former du carbonate, qui peut se déposer et ainsi endommager la cellule". Il s'agit donc ici de trouver un compromis optimal entre les différentes vis de réglage de l'électrolyse, selon Brückner.
Pour le trouver, l'équipe de chercheurs a développé un coefficient spécial qui permet de déterminer plus facilement les conditions optimales du processus. Il contient dans une formule mathématique les taux de production de CO et d'hydrogène ainsi que la quantité deCO2 toujours présente à la sortie de la première cellule. "Nous mesurons les concentrations de ces substances dans un chromatographe en phase gazeuse. En outre, nous déterminons également la concentration de l'azote gazeux que nous ajoutons dans une quantité définie", explique Brückner. Cet "étalonnage" permet de déterminer le débit total à travers la cellule. Comme on peut relever toutes ces valeurs en permanence pendant le fonctionnement de la cellule, on peut constater immédiatement les effets des modifications des paramètres de fonctionnement. Parallèlement, les valeurs mesurées servent également de système d'alerte précoce pour savoir si la cellule risque de tomber en panne et si des mesures correctives sont nécessaires.
Une économie durable du carbone avec leCO2 comme matière première
"L'objectif final de ces recherches est d'établir une économie circulaire et durable du carbone", explique Peter Strasser. "Un grand avantage de notre procédé est également que nous n'avons pas besoin d'hydrogène supplémentaire pour l'électrolyse directe duCO2 en hydrocarbures utiles en utilisant de l'électricité et de l'eau". Il en va différemment des procédés durables traditionnels qui, soit pour transformer leCO2 en CO, soit pour produire des hydrocarbures à partir du CO, utilisent de l'hydrogène qui doit être produit avec de l'énergie supplémentaire, stocké et éventuellement encore transporté. "Les produits chimiques de base qui utilisent leCO2 de l'air plutôt que le pétrole comme source de carbone peuvent effectivement réduire la teneur en dioxyde de carbone de l'atmosphère dans certaines conditions. Les e-carburants verts issusdu CO2 ont au moins un bilan carbone équilibré après leur combustion", résume Strasser.
Note: Cet article a été traduit à l'aide d'un système informatique sans intervention humaine. LUMITOS propose ces traductions automatiques pour présenter un plus large éventail d'actualités. Comme cet article a été traduit avec traduction automatique, il est possible qu'il contienne des erreurs de vocabulaire, de syntaxe ou de grammaire. L'article original dans Allemand peut être trouvé ici.







































