Production d'hydrogène vert plus durable et à plus long terme
Les résultats ont une incidence sur la capacité à mettre en place une économie énergétique durable basée sur l'hydrogène
Annonces
Des chercheurs dirigés par Ryuhei Nakamura du RIKEN Center for Sustainable Resource Science (CSRS) au Japon ont amélioré leur méthode verte et durable d'extraction de l'hydrogène à partir de l'eau en utilisant un catalyseur sur mesure pour la réaction chimique. Publiée dans Nature Catalysis, l'étude explique en détail comment ils ont manipulé la structure 3D du catalyseur, ce qui a permis d'améliorer la stabilité et d'augmenter la durée de vie du catalyseur de près de 4 000 %. Ces résultats ont une incidence sur la capacité à mettre en place une économie énergétique durable basée sur l'hydrogène.

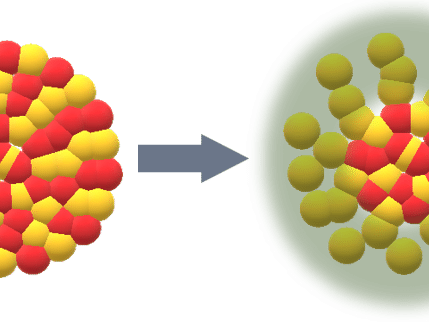
Electrolyseur d'eau à membrane d'échange de protons (PEM) utilisant de l'oxyde de manganèse.
RIKEN
L'électrolyse de l'eau à l'aide de membranes d'échange de protons est un procédé électrochimique écologique qui permet de séparer l'eau en oxygène et en hydrogène. L'hydrogène ainsi produit peut être stocké et utilisé ultérieurement. Par exemple, lorsqu'il est associé à une pile à combustible à membrane échangeuse de protons (PEM), l'hydrogène stocké peut être utilisé pour alimenter une voiture électrique. Toutefois, l'électrolyse PEM présente encore des limites qui empêchent une utilisation industrielle à grande échelle, par exemple dans les centrales électriques. En particulier, les réactions chimiques nécessaires se produisent dans un environnement très acide, et les meilleurs catalyseurs pour ces réactions sont des métaux de terre extrêmement rares, tels que l'iridium. Comme l'explique M. Nakamura, "pour porter l'électrolyse PEM à l'échelle du térawatt, il faudrait disposer d'iridium pendant 40 ans, ce qui n'est certainement pas pratique et très peu durable".
Il y a près de deux ans, Nakamura et son équipe ont mis au point un procédé révolutionnaire permettant l'électrolyse de l'eau acide sans recourir aux métaux des terres rares. En insérant du manganèse dans un réseau d'oxyde de cobalt, ils ont créé un processus qui repose uniquement sur des métaux terrestres communs et durables. Malgré ce succès, le processus n'était toujours pas aussi stable qu'il devrait l'être dans un électrolyseur PEM. Aujourd'hui, les chercheurs se sont appuyés sur leur découverte précédente pour mettre au point un catalyseur à base de métaux terrestres plus durable.
Le nouveau catalyseur est une forme d'oxyde de manganèse (MnO2). La principale découverte est que la stabilité de la réaction peut être multipliée par plus de 40 en modifiant la structure du réseau du catalyseur. L'oxygène dans la structure du réseau 3D de l'oxyde de manganèse se présente sous deux configurations, planaire et pyramidale. La version planaire forme des liaisons plus fortes avec le manganèse, et les chercheurs ont découvert que l'augmentation de la quantité d'oxygène planaire dans le réseau améliorait considérablement la stabilité du catalyseur.
Ils ont testé quatre oxydes de manganèse différents, dont le pourcentage d'oxygène planaire variait. En utilisant la version présentant le pourcentage le plus élevé (94 %), la réaction critique de dégagement d'oxygène a pu être maintenue dans l'acide pendant un mois à 1 000 mA/cm2. La quantité totale de charge transférée dans ce cas était 100 fois supérieure à ce qui avait été observé dans les études précédentes.
Testée dans un électrolyseur PEM, l'électrolyse de l'eau a pu être maintenue pendant environ 6 semaines à 200 mA/cm2. La quantité totale d'eau électrolysée pendant cette période, et donc la quantité d'hydrogène produite, était 10 fois supérieure à ce qui avait été obtenu par le passé avec d'autres catalyseurs à base de métaux non rares. "Il est surprenant de constater que l'amélioration de la stabilité ne s'est pas faite au détriment de l'activité, comme c'est généralement le cas", explique Shuang Kong, coauteur de l'étude. Un électrolyseur d'eau PEM qui produit de l'hydrogène avec un catalyseur à base de métaux rares à un taux de 200 mA/cm2 est très efficace".
Il reste encore du travail à faire. Les applications industrielles nécessitent généralement une densité de courant stable de 1000 mA/cm2 qui dure plusieurs années, plutôt qu'un mois. Néanmoins, les chercheurs pensent que des applications concrètes dans le monde réel seront finalement possibles et contribueront à la neutralité carbone. "Nous continuerons à modifier la structure du catalyseur pour augmenter à la fois la densité de courant et la durée de vie du catalyseur", déclare Nakamura. "À long terme, nos efforts devraient permettre d'atteindre l'objectif ultime pour toutes les parties prenantes : réaliser l'électrolyse de l'eau PEM sans utiliser d'iridium."
En attendant, les chercheurs espèrent que leurs résultats susciteront l'intérêt du public pour la production durable d'hydrogène en tant que solution réaliste pour ralentir le changement climatique lié aux combustibles fossiles.
Note: Cet article a été traduit à l'aide d'un système informatique sans intervention humaine. LUMITOS propose ces traductions automatiques pour présenter un plus large éventail d'actualités. Comme cet article a été traduit avec traduction automatique, il est possible qu'il contienne des erreurs de vocabulaire, de syntaxe ou de grammaire. L'article original dans Anglais peut être trouvé ici.