Comprendre l'activité des catalyseurs pour la production d'hydrogène vert
La recherche est prometteuse pour l'amélioration des technologies de conversion de l'énergie
Annonces
Des chercheurs de l'Institut Fritz Haber de la Société Max Planck ont dévoilé de nouvelles informations sur l'activité des catalyseurs utilisés dans la production d'hydrogène vert. Leur étude, publiée dans Nature Chemistry, explore la façon dont la cinétique du catalyseur est liée à une interaction complexe entre le solvant interfacial et les changements chimiques à la surface du catalyseur, ouvrant potentiellement la voie à des technologies de conversion énergétique plus efficaces.
© FHI
Introduction à l'activité des catalyseurs
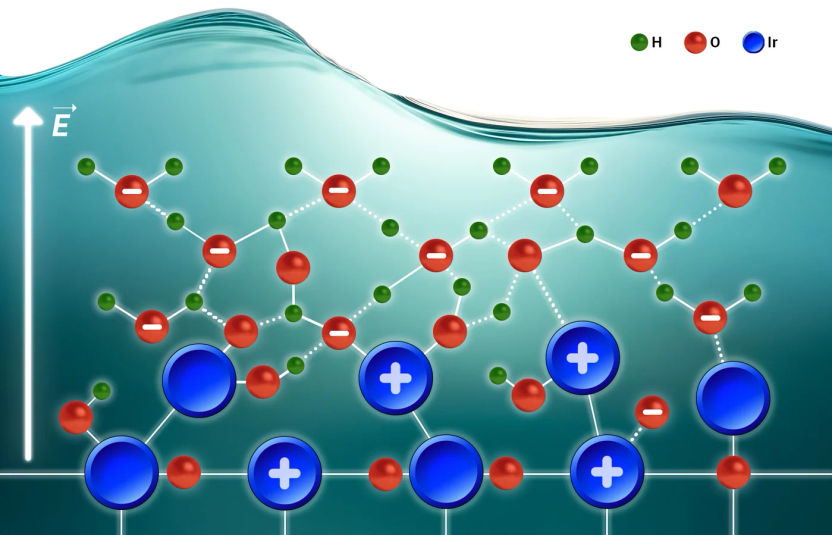
Le département de la science des interfaces de l'Institut Fritz Haber a fait des progrès considérables dans la compréhension du fonctionnement des catalyseurs en milieu aqueux. Cette recherche est cruciale pour faire progresser des technologies telles que la production d'hydrogène vert, qui repose sur des catalyseurs efficaces pour diviser les molécules d'eau.
Découverte d'un point de transition
Martinez-Hincapié et Oener au sein du département FHI du professeur Roldán Cuenya utilise l'électrochimie en fonction de la température et la spectroscopie operando pour étudier la réaction d'évolution de l'oxygène (OER). Cette réaction est un goulot d'étranglement dans l'électrolyse de l'eau, où la cinétique lente de la réaction de dégagement de l'oxygène peut entraver la production d'hydrogène. Les chercheurs ont découvert un point de transition clé dans la cinétique dépendante du biais, où l'activité du catalyseur passe d'une limitation par l'accumulation d'une charge excédentaire à une activité élevée.
Le rôle de la solvatation
L'une des conclusions essentielles de l'étude est le rôle de la solvatation interfaciale - un processus par lequel les ions perdent ou gagnent des molécules de solvant. Cette étape initiale semble être cruciale pour l'activité intrinsèque du catalyseur. Le Dr Oener explique : "Nous devrions vraiment considérer l'interphase catalyseur-électrolyte comme un tout, et non comme un tout séparé. Nous ne pouvons pas comprendre la stabilisation de l'excès de charge du côté solide sans la réponse du solvant et nous ne pouvons pas comprendre la solvatation des ions interfaciaux sans considérer attentivement ce qui se passe du côté solide. Ceci est d'autant plus important que l'interface solide subit également des changements structurels et chimiques drastiques au cours de la réaction. C'est une interphase qui est à l'origine de l'activité observée".
Perspectives techniques
En termes plus techniques, l'étude révèle que la cinétique du catalyseur est régie par une interaction complexe entre l'adaptation chimique et structurelle de la surface de l'oxyde et la réponse des molécules d'eau interfaciales. En utilisant la spectroscopie à rayons X operando, l'équipe a observé des adaptations structurelles et chimiques des catalyseurs à base d'oxyde juste à un potentiel de transition important dans la cinétique. Il est important de noter que ce potentiel de transition est indépendant de la charge du catalyseur (la quantité de matériau utilisée) et de sa surface. Cela indique que l'activité du catalyseur est intrinsèquement liée à sa capacité à accumuler une charge excédentaire pour interagir avec les ions solvatés de l'électrolyte liquide.
Conclusion et orientations futures
Beatriz Roldán Cuenya souligne l'importance de combiner différentes techniques de spectro-microscopie operando qui fournissent des informations sur la surface du catalyseur, le solvant et la cinétique fondamentale. Cela est nécessaire pour mieux comprendre le comportement du catalyseur. La recherche ne fait pas seulement progresser notre compréhension de l'activité du catalyseur, elle est également prometteuse pour l'amélioration des technologies de conversion de l'énergie. L'équipe s'est engagée à poursuivre l'exploration de ces résultats, qui pourraient avoir un impact significatif sur les domaines de l'énergie et de la technologie de conversion chimique.
Note: Cet article a été traduit à l'aide d'un système informatique sans intervention humaine. LUMITOS propose ces traductions automatiques pour présenter un plus large éventail d'actualités. Comme cet article a été traduit avec traduction automatique, il est possible qu'il contienne des erreurs de vocabulaire, de syntaxe ou de grammaire. L'article original dans Anglais peut être trouvé ici.
Publication originale
Ricardo Martínez-Hincapié, Janis Timoshenko, Timon Wagner, Eduardo Ortega, Jody Druce, Mariana C. O. Monteiro, Martina Rüscher, Joonbaek Jang, Elif Öykü Alagöz, Samuele Lasagna, Leon Jacobse, Arno Bergmann, Beatriz Roldan Cuenya, Sebastian Z. Oener; "Interfacial solvation pre-organizes the transition state of the oxygen evolution reaction"; Nature Chemistry, 2025-9-3







































