PFAS : une nouvelle voie pour éliminer les "produits chimiques éternels"
Mise au point d'un nouveau catalyseur capable de rompre les liaisons carbone-fluor fortes - utilisation potentielle dans la production pharmaceutique
Des chimistes de l'université Goethe de Francfort ont mis au point un catalyseur capable de décomposer de manière ciblée les substances organiques per- et polyfluorées (PFAS), également connues sous le nom de "forever chemicals". Les PFAS sont largement utilisées pour rendre les surfaces résistantes à la saleté et à l'eau, mais leur extrême persistance dans l'environnement et les risques potentiels pour la santé en font une préoccupation croissante. Ce nouveau catalyseur se distingue par le fait qu'il ne fait pas appel à des métaux lourds coûteux ou toxiques comme le platine, le palladium ou l'iridium. Outre sa capacité à dégrader les PFAS, le catalyseur pourrait également être utilisé dans la synthèse de produits pharmaceutiques.
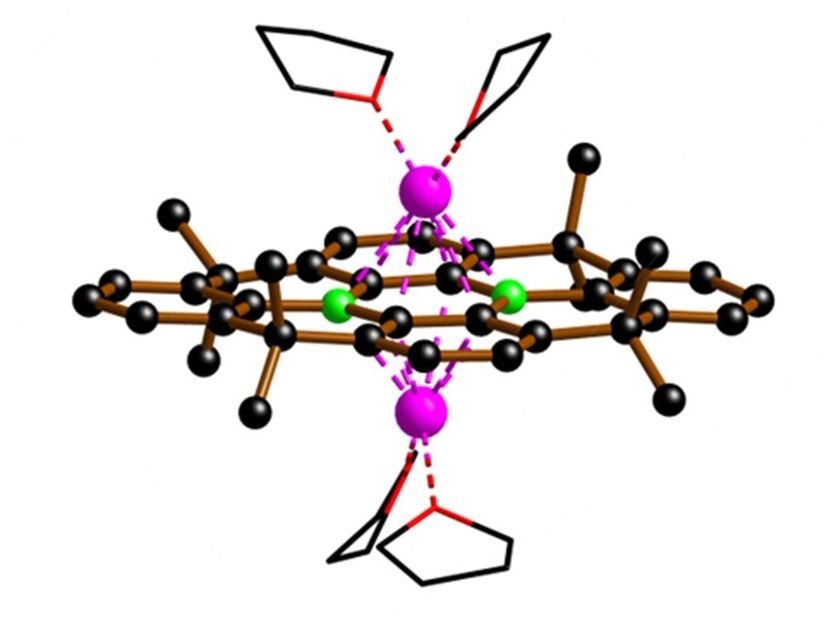
Un nouveau catalyseur rompt les liaisons C-F : Deux atomes de bore (sphères vertes) sont intégrés dans un cadre d'atomes de carbone (noir). Les électrons nécessaires à la rupture des liaisons C-F proviennent actuellement du lithium (rose) et, à l'avenir, du courant électrique.
Gruppe von Matthias Wagner, Goethe-Universität Frankfurt
Les PFAS sont, à bien des égards, des molécules remarquables. Même une fine couche peut repousser l'eau, l'huile et la saleté. Ils sont également très résistants à la chaleur et aux UV, ce qui les rend idéaux pour recouvrir les vêtements d'extérieur respirants, les tapis antitaches, la vaisselle jetable, les fers à repasser et les poêles antiadhésives. Dans l'industrie, les PFAS sont utilisés comme lubrifiants, surfactants, agents mouillants, dans le chromage et dans les mousses anti-incendie. La liste est longue - les PFAS sont presque partout.
Mais ces avantages ont un coût : les PFAS étant très résistants, ils persistent dans l'environnement longtemps après l'usage auquel ils sont destinés. Bien qu'elles puissent être presque entièrement détruites dans les usines d'incinération des déchets, elles peuvent s'accumuler dans le cycle des matériaux lors du recyclage - y compris dans les textiles ou les boues d'épuration - et ensuite pénétrer dans l'environnement. Les PFAS peuvent se retrouver dans l'eau, le sol, les plantes et même dans le corps humain. Cette situation est d'autant plus préoccupante que certains des quelque 4 700 composés PFAS connus sont soupçonnés d'être cancérigènes ou de provoquer d'autres problèmes de santé.
La clé de l'efficacité des PFAS - et de leur persistance dans l'environnement - réside dans leur structure moléculaire extrêmement stable, en particulier les liaisons carbone-fluor (C-F). Une équipe de chimistes dirigée par le professeur Matthias Wagner de l'Institut de chimie inorganique et analytique de l'université Goethe a mis au point un catalyseur capable de rompre ces liaisons C-F en quelques secondes et à température ambiante. Le cœur du catalyseur est constitué de deux atomes de bore, qui ont été intégrés dans une structure de carbone d'une manière qui les rend résistants à l'air et à l'humidité - une propriété rare et très pratique pour les composés de bore.
Christoph Buch, chercheur doctorant dans le groupe de Wagner et premier auteur de l'étude, explique : "Pour rompre les liaisons C-F, nous avons besoin d'électrons, que notre catalyseur transfère avec une efficacité exceptionnelle. Jusqu'à présent, nous avons utilisé des métaux alcalins comme le lithium comme source d'électrons, mais nous envisageons déjà de passer au courant électrique. Cela rendrait le processus à la fois beaucoup plus simple et plus efficace".
Au-delà de la dégradation des PFAS, M. Wagner voit des applications plus larges pour le catalyseur : "De nombreuses substances importantes sur le plan pharmacologique contiennent des atomes de fluor afin d'accroître leur stabilité physiologique et de renforcer leur effet. Les atomes de fluor peuvent également améliorer l'absorption des médicaments. Grâce à ce catalyseur, nous disposons désormais d'un outil qui nous permet de contrôler avec précision le degré de fluoration de ces composés."
Note: Cet article a été traduit à l'aide d'un système informatique sans intervention humaine. LUMITOS propose ces traductions automatiques pour présenter un plus large éventail d'actualités. Comme cet article a été traduit avec traduction automatique, il est possible qu'il contienne des erreurs de vocabulaire, de syntaxe ou de grammaire. L'article original dans Anglais peut être trouvé ici.
Publication originale
Christoph D. Buch, Alexander Virovets, Eugenia Peresypkina, Burkhard Endeward, Hans-Wolfram Lerner, Felipe Fantuzzi, Shigehiro Yamaguchi, Matthias Wagner; "Planarity Is Not Plain: Closed- vs Open-Shell Reactivity of a Structurally Constrained, Doubly Reduced Arylborane toward Fluorobenzenes"; Journal of the American Chemical Society, Volume 147, 2025-5-29