Carburants solaires de nouvelle génération : comment un catalyseur en cuivre record convertit le CO₂ en carburants liquides
Des chercheurs ont filmé en temps réel l'évolution de nanoparticules de cuivre pour convertir le dioxyde de carbone et l'eau en carburants et produits chimiques renouvelables
Annonces
Depuis les années 1970, les scientifiques savent que le cuivre possède une capacité particulière à transformer le dioxyde de carbone en produits chimiques et en carburants précieux. Mais pendant de nombreuses années, les scientifiques ont eu du mal à comprendre comment ce métal commun fonctionne comme un électrocatalyseur, un mécanisme qui utilise l'énergie des électrons pour transformer chimiquement les molécules en différents produits.

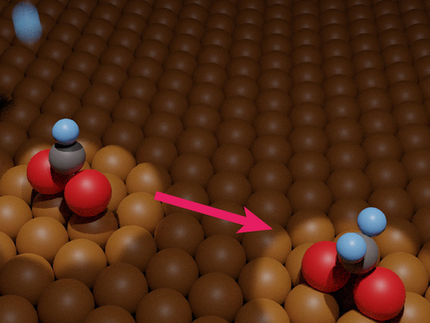
Représentation artistique d'une nanoparticule de cuivre lors de son évolution pendant l'électrolyse du CO2 : Les nanoparticules de cuivre (à gauche) se combinent en "nanograins" de cuivre métallique plus grands (à droite) en quelques secondes de la réaction électrochimique, réduisant le CO2 en nouveaux produits multicarbones.
Yao Yang/Berkeley Lab
Aujourd'hui, une équipe de recherche dirigée par le Lawrence Berkeley National Laboratory (Berkeley Lab) a acquis de nouvelles connaissances en filmant en temps réel des nanoparticules de cuivre (particules de cuivre fabriquées à l'échelle d'un milliardième de mètre) alors qu'elles convertissent leCO2 et l'eau en carburants et produits chimiques renouvelables : éthylène, éthanol et propanol, entre autres. Ces travaux ont été publiés dans la revue Nature.
"C'est très excitant. Après des décennies de travail, nous sommes enfin en mesure de montrer - avec des preuves indéniables - comment les électrocatalyseurs à base de cuivre excellent dans la réduction duCO2 ", a déclaré Peidong Yang, chercheur principal au sein des divisions des sciences des matériaux et des sciences chimiques du Berkeley Lab, qui a dirigé l'étude. Yang est également professeur de chimie et de science et ingénierie des matériaux à l'UC Berkeley. "Savoir comment le cuivre est un si excellent électrocatalyseur nous rapproche un peu plus de la transformation duCO2 en nouveaux carburants solaires renouvelables par photosynthèse artificielle."
Ces travaux ont été rendus possibles par la combinaison d'une nouvelle technique d'imagerie appelée STEM (microscopie électronique à transmission à balayage) électrochimique à cellule liquide 4D operando et d'une sonde à rayons X mous pour étudier le même environnement d'échantillon : des nanoparticules de cuivre dans un liquide. Le premier auteur, Yao Yang, titulaire d'une bourse postdoctorale Miller de l'UC Berkeley, a conçu cette approche révolutionnaire sous la direction de Peidong Yang alors qu'il préparait son doctorat en chimie à l'université Cornell.
Les scientifiques qui étudient les matériaux et les réactions de la photosynthèse artificielle ont voulu combiner la puissance d'une sonde électronique avec les rayons X, mais les deux techniques ne peuvent généralement pas être réalisées par le même instrument.
Les microscopes électroniques (tels que STEM ou TEM) utilisent des faisceaux d'électrons et excellent dans la caractérisation de la structure atomique de certaines parties d'un matériau. Ces dernières années, les instruments STEM 4D (ou "trame 2D de diagrammes de diffraction 2D utilisant la microscopie électronique à transmission à balayage"), tels que ceux de la Molecular Foundry du Berkeley Lab, ont repoussé encore plus loin les limites de la microscopie électronique, permettant aux scientifiques de cartographier des régions atomiques ou moléculaires dans une variété de matériaux, du verre métallique dur aux films souples et flexibles.
D'autre part, les rayons X mous (ou de plus faible énergie) sont utiles pour identifier et suivre les réactions chimiques en temps réel dans un environnement opératif, ou monde réel.
Désormais, les scientifiques peuvent bénéficier du meilleur des deux mondes. Au cœur de cette nouvelle technique se trouve un porte-échantillon électrochimique à "cellule liquide" d'une polyvalence remarquable. Mille fois plus fin qu'un cheveu humain, le dispositif est compatible avec les instruments STEM et à rayons X.
La conception ultra-mince de la cellule liquide électrochimique permet une imagerie fiable des échantillons délicats tout en les protégeant des dommages causés par le faisceau d'électrons. Une électrode spéciale, conçue sur mesure par le co-auteur Cheng Wang, chercheur à l'Advanced Light Source du Berkeley Lab, a permis à l'équipe de mener des expériences aux rayons X avec la cellule liquide électrochimique. La combinaison des deux permet aux chercheurs de caractériser de manière exhaustive les réactions électrochimiques en temps réel et à l'échelle nanométrique.
Devenir granulaire
Au cours d'expériences 4D-STEM, Yao Yang et son équipe ont utilisé la nouvelle cellule liquide électrochimique pour observer l'évolution de nanoparticules de cuivre (dont la taille varie de 7 à 18 nanomètres) en nanograins actifs pendant l'électrolyse duCO2 - un processus qui utilise l'électricité pour provoquer une réaction à la surface d'un électrocatalyseur.
Les expériences ont révélé une surprise : les nanoparticules de cuivre se sont combinées en "nanograins" de cuivre métallique plus grands dans les secondes qui ont suivi la réaction électrochimique.
Pour en savoir plus, l'équipe s'est tournée vers Wang, qui a mis au point une technique connue sous le nom de "diffusion résonante des rayons X mous (RSoXS) pour les matériaux mous", au Centre de rayonnement avancé, il y a plus de dix ans.
Avec l'aide de Wang, l'équipe de recherche a utilisé la même cellule liquide électrochimique, mais cette fois au cours d'expériences RSoXS, pour déterminer si les nanograins de cuivre facilitent la réduction duCO2 . Les rayons X mous sont idéaux pour étudier l'évolution des électrocatalyseurs de cuivre pendant la réduction duCO2, explique Wang. En utilisant la RSoXS, les chercheurs peuvent suivre en temps réel de multiples réactions entre des milliers de nanoparticules et identifier avec précision les réactifs et les produits chimiques.
Les expériences RSoXS menées au Centre de rayonnement synchrotron avancé - ainsi que d'autres preuves recueillies à la Cornell High Energy Synchrotron Source (CHESS) - ont prouvé que les nanograins de cuivre métallique servent de sites actifs pour la réduction duCO2. (Le cuivre métallique, également connu sous le nom de cuivre(0), est une forme de l'élément cuivre).
Au cours de l'électrolyse duCO2, les nanoparticules de cuivre modifient leur structure au cours d'un processus appelé "brouillage électrochimique". La couche d'oxyde à la surface des nanoparticules de cuivre se dégrade, créant des sites ouverts à la surface du cuivre où les molécules deCO2 peuvent se fixer, explique Peidong Yang. Et lorsque leCO2 "s'arrime" ou se lie à la surface des nanograins de cuivre, des électrons sont alors transférés auCO2, provoquant une réaction qui produit simultanément de l'éthylène, de l'éthanol et du propanol, ainsi que d'autres produits multicarbonés.
"Les nanograins de cuivre deviennent essentiellement de petites usines de fabrication de produits chimiques", a déclaré Yao Yang.
D'autres expériences menées à la Fonderie moléculaire, à l'Advanced Light Source et au CHESS ont révélé que la taille avait son importance. Toutes les nanoparticules de cuivre de 7 nanomètres ont participé à la réduction duCO2, alors que les nanoparticules plus grandes ne l'ont pas fait. En outre, l'équipe a appris que seul le cuivre métallique peut réduire efficacement leCO2 en produits multicarbonés. Ces résultats ont des implications pour "la conception rationnelle d'électrocatalyseurs deCO2 efficaces", a déclaré Peidong Yang.
La nouvelle étude a également validé les résultats obtenus par Peidong Yang en 2017 : Que les nanoparticules de cuivre de 7 nanomètres nécessitent de faibles apports d'énergie pour démarrer la réduction duCO2. En tant qu'électrocatalyseur, les nanoparticules de cuivre de 7 nanomètres ont nécessité une force motrice record, soit environ 300 millivolts de moins que les électrocatalyseurs de cuivre en vrac typiques. Les catalyseurs les plus performants, qui produisent des produits multicarbonés à partir duCO2, fonctionnent généralement avec une force motrice élevée de 1 volt.
Les nanograins de cuivre pourraient potentiellement améliorer l'efficacité énergétique et la productivité de certains catalyseurs conçus pour la photosynthèse artificielle, un domaine de recherche qui vise à produire des combustibles solaires à partir de la lumière du soleil, de l'eau et duCO2. Actuellement, les chercheurs de l'Alliance pour la lumière solaire liquide (LiSA), financée par le ministère de l'énergie, prévoient d'utiliser les catalyseurs à nanograins de cuivre dans la conception de futurs dispositifs à combustible solaire.
"La capacité de cette technique à enregistrer des films en temps réel d'un processus chimique ouvre des perspectives intéressantes pour l'étude de nombreux autres processus de conversion électrochimique de l'énergie. Il s'agit d'une avancée considérable, qui n'aurait pas été possible sans Yao et son travail de pionnier", a déclaré Peidong Yang.
Note: Cet article a été traduit à l'aide d'un système informatique sans intervention humaine. LUMITOS propose ces traductions automatiques pour présenter un plus large éventail d'actualités. Comme cet article a été traduit avec traduction automatique, il est possible qu'il contienne des erreurs de vocabulaire, de syntaxe ou de grammaire. L'article original dans Anglais peut être trouvé ici.