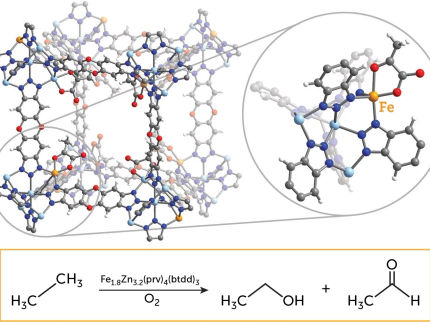
Les rayons X permettent de visualiser la rupture de l'une des liaisons les plus solides de la nature
L'étude résout un mystère vieux de quarante ans : Une étape cruciale dans la conversion du méthane en produits chimiques utiles
Annonces
L'utilisation de brefs éclairs de rayons X permet aux scientifiques de faire un grand pas vers la mise au point de meilleurs catalyseurs pour transformer le méthane, un gaz à effet de serre, en un produit chimique moins nocif. Le résultat, publié dans la revue Science, révèle pour la première fois comment les liaisons carbone-hydrogène des alcanes se brisent et comment le catalyseur fonctionne dans cette réaction.
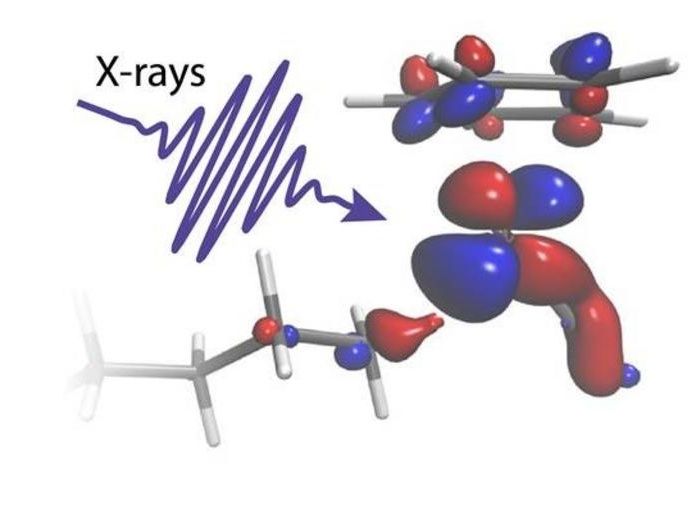
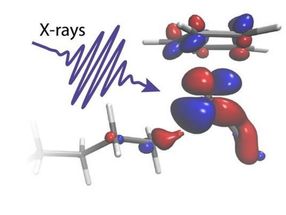
Un flash de rayons X illumine une molécule
Raphael Jay

Raphael Jay, chercheur au département de physique et d'astronomie de l'université d'Uppsala
Mikael Wallerstedt

Philippe Wernet, professeur au département de physique et d'astronomie de l'université d'Uppsala
Mikael Wallerstedt


Le méthane, l'un des gaz à effet de serre les plus puissants, est rejeté dans l'atmosphère à un rythme croissant en raison de l'élevage et du dégel continu du pergélisol. La transformation du méthane et des alcanes à chaîne plus longue en produits chimiques moins nocifs et en fait utiles permettrait d'éliminer les menaces associées et de disposer d'une énorme matière première pour l'industrie chimique. Cependant, la transformation du méthane nécessite dans un premier temps la rupture d'une liaison C-H, l'une des liaisons chimiques les plus fortes dans la nature.
Il y a quarante ans, on a découvert des catalyseurs métalliques moléculaires capables de rompre facilement les liaisons C-H. La seule chose dont on a eu besoin, c'est d'un catalyseur moléculaire. Il suffit d'un bref éclair de lumière visible pour "allumer" le catalyseur et, comme par magie, les fortes liaisons C-H des alcanes passant à proximité sont facilement rompues, presque sans utiliser d'énergie. Malgré l'importance de cette réaction dite d'activation C-H, la manière dont le catalyseur remplit cette fonction est restée inconnue pendant des décennies.
La recherche a été menée par des scientifiques de l'université d'Uppsala en collaboration avec l'Institut Paul Scherrer en Suisse, l'université de Stockholm, l'université de Hambourg et le XFEL européen en Allemagne. Pour la première fois, les scientifiques ont pu observer directement le catalyseur à l'œuvre et révéler comment il rompt ces liaisons C-H.
Lors de deux expériences menées à l'Institut Paul Scherrer en Suisse, les chercheurs ont pu suivre le délicat échange d'électrons entre un catalyseur au rhodium et un groupe C-H d'octane au fur et à mesure qu'il se rompait. En utilisant deux des plus puissantes sources de flashs de rayons X au monde, le laser à rayons X SwissFEL et le synchrotron à rayons X Swiss Light Source, la réaction a pu être suivie du début à la fin. Les mesures ont révélé l'activation initiale du catalyseur induite par la lumière en 400 femtosecondes (0,0000000000004 secondes) jusqu'à la rupture finale de la liaison C-H après 14 nanosecondes (0,000000014 secondes).
"Les expériences d'absorption de rayons X résolues dans le temps que nous avons réalisées ne sont possibles que dans des installations à grande échelle comme le SwissFEL et la Source de Lumière Suisse, qui fournissent des impulsions de rayons X extrêmement brillantes et courtes. Le catalyseur est immergé dans une solution dense d'octane, mais en adoptant la perspective du métal, nous avons pu choisir spécifiquement la liaison C-H parmi des centaines de milliers qui est amenée à se rompre", explique Raphael Jay, chercheur à l'université d'Uppsala et expérimentateur principal de l'étude.
Pour interpréter les données expérimentales complexes, des théoriciens de l'université d'Uppsala et de l'université de Stockholm se sont associés et ont effectué des calculs chimiques quantiques avancés.
"Nos calculs nous permettent d'identifier clairement comment la charge électronique circule entre le catalyseur métallique et le groupe C-H dans la bonne proportion. Nous pouvons voir comment la charge circulant du métal vers la liaison C-H colle les deux groupes chimiques ensemble. La charge circulant dans la direction opposée agit comme un ciseau qui finit par séparer les atomes C et H", explique Ambar Banerjee, chercheur postdoctoral à l'université d'Uppsala et théoricien principal de l'étude.
L'étude résout un mystère vieux de quarante ans, à savoir comment un catalyseur activé peut effectivement briser de fortes liaisons C-H en échangeant soigneusement des fractions d'électrons et sans avoir besoin de températures ou de pressions élevées. Forts de leur nouvel outil, les chercheurs veulent maintenant apprendre à diriger le flux d'électrons afin de développer de meilleurs catalyseurs pour l'industrie chimique et de pouvoir tirer quelque chose d'utile du méthane et d'autres alcanes.
Note: Cet article a été traduit à l'aide d'un système informatique sans intervention humaine. LUMITOS propose ces traductions automatiques pour présenter un plus large éventail d'actualités. Comme cet article a été traduit avec traduction automatique, il est possible qu'il contienne des erreurs de vocabulaire, de syntaxe ou de grammaire. L'article original dans Anglais peut être trouvé ici.